今日,景澤生物的JZB05“重組人血管內皮生長因子受體-抗體融合蛋白眼內注射液”喜獲國家食品藥品監督管理總局藥品審評中心(CDE)臨牀試驗批件。公司將盡快啓動Ⅰ期臨牀試驗,評估JZB05的安全性、耐受性、藥代動力學特性。繼去年10月份眼科JZB32正式進入Ⅰ期臨牀試驗後,景澤生物眼科產品線再下一城,喜獲開門紅。
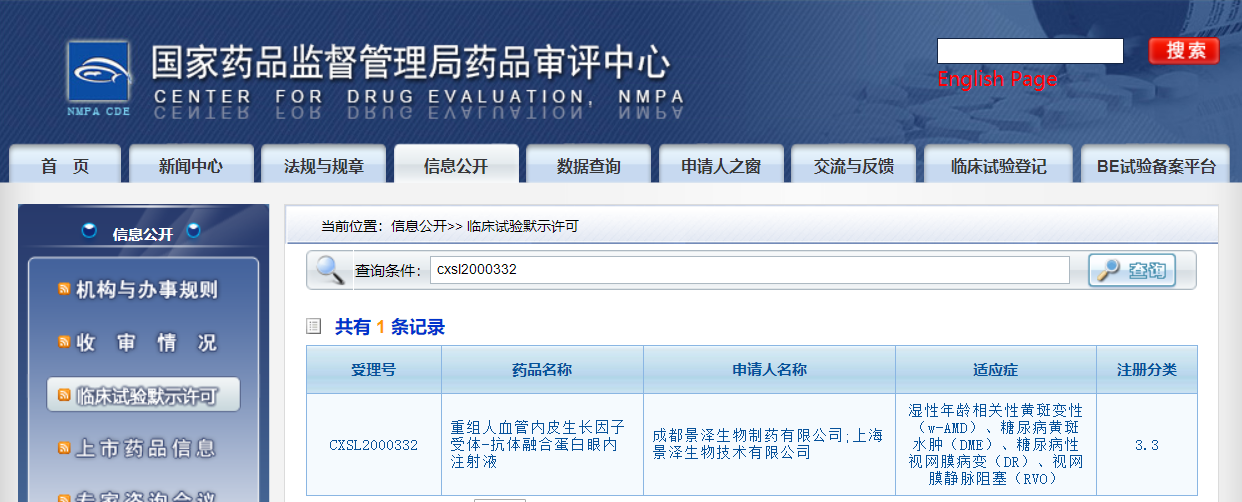
JZB05爲2019年銷售額超過74億美元的阿柏西普的生物類似藥,由成都景澤生物製藥有限公司和上海景澤生物技術有限公司申報,用於治療溼性年齡相關性黃斑變性(wAMD)、糖尿病黃斑水腫(DME)、糖尿病性視網膜病變(DR)、視網膜靜脈阻塞(RVO)等眼底新生血管性疾病。據研報預測,中國抗VEGF藥物市場潛力將於2030年超過400億元,JZB05市場前景廣闊,將成爲公司眼科產品線另一重磅產品。
景澤生物將繼續在眼科領域深耕細作,憑藉全球First in class技術平臺“核酸納米遞送系統”,在乾眼症、青光眼、眼底黃斑變性等領域全力出擊,爭取成爲世界一流的眼科創新型藥物開發企業,爲廣大的眼病患者提供更多更優質的藥品。
